在 ICU 患者中,脓毒症和感染性休克的发病率和死亡率居高不下,因此优化抗生素暴露是关键的治疗措施,如何优化重症患者抗菌药物浓度是治疗重症患者感染的重要环节。合适的治疗性抗菌药物浓度可以有效改善临床治愈、减少药物毒性、降低重症感染患者的死亡率 [1-3]。然而,重症患者病情复杂,伴随重要器官功能不全(肝脏、肾脏等),同时与治疗相关的因素如 CRRT、ECMO 等也会给抗菌药物浓度带来直接影响,使得优化抗菌药物这一过程复杂化。需要根据个体化的原则制定抗菌药物的剂量策略,以确保实现与患者利益相关的抗菌药物暴露。
最近有一项问卷调查结果显示,重症医学科医生对抗菌药物的个体化治疗缺乏相关的知识和临床应对能力,迫切需要加强在这方面知识的培训和教育工作。本文中我们一起来了解有关抗菌药物暴露带来临床获益或有害的相关内容; 有助于加深认识如何评估重症患者,从而进行有效治疗,为重症患者提供个性化的治疗方法,尽可能实现实现抗菌药物暴露的治疗剂量。
大量关于抗菌药物的研究显示,包括肺炎、血流感染和感染性休克,抗菌药物暴露 (以药代动力学/药效学 (PK/PD) 表示) 与患者预后有关 [3,5,6]。这些研究数据包括β-内酰胺类、碳青霉烯类、喹诺酮类、万古霉素、利奈唑胺、氨基糖苷类 [1,3,4]。虽然这些研究都是回顾性的临床评价数据、药代动力学研究,与体外研究结果一致,具有生物合理性 [4]。体外研究显示合适的抗菌药物暴露可抑制耐药性的发生 [7]。此外,通过体外研究也可获得过量药物暴露与药物毒性相关的数据。为此, 目前研究均证实使用监测抗生素剂量的方法能确保药物的合理暴露, 与改善病人预后有关。国际临床指南,如机械通气相关肺炎和医院获得性肺炎的治疗均有推荐 [9,10]。
实现抗菌药物目标暴露面临的突出挑战是抗菌药物药代动力学变异,这导致很难预测最佳剂量。药物代谢动力学的变化是由药物清除的巨大变异引起的,主要是肾功能的变化,从肾脏清除力亢进 (由感染导致的全身炎症反应引起的超正常肌酐清除) 到急性严重肾损伤。其次,β-内酰胺类、氨基糖苷类和糖肽类等亲水性抗菌药物分布容积的变化也会影响所需剂量。最后,肾脏替代治疗(RRT)和体外膜氧合(ECMO)等体外治疗对抗菌药物剂量的影响难以预测。
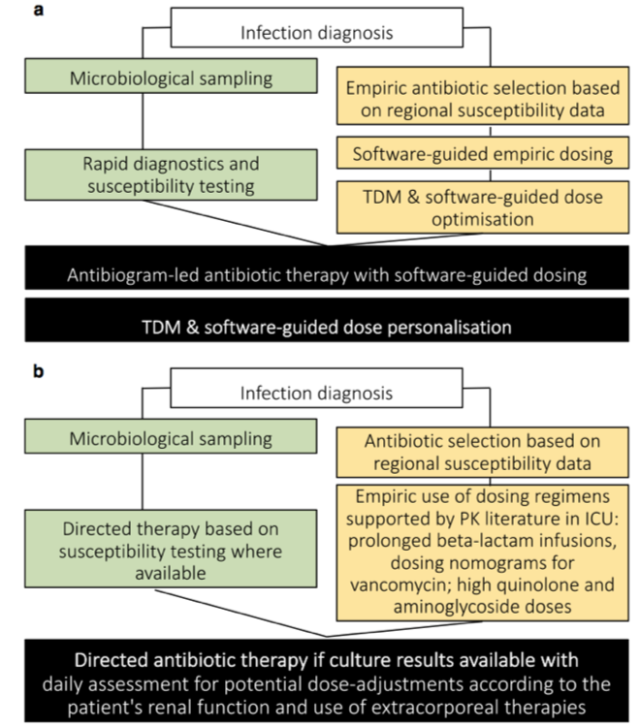
确保抗菌药物最佳暴露的另一个挑战是,抗菌药物最佳暴露剂量取决于致病病原体对药物的敏感性,即抗菌药物对细菌的最低抑制浓度 (MIC)。流行病学资料表明,重症患者容易感染不敏感病原体 [11]。在这种情况下,PK/PD 指数的 MIC 或分母更高,需要更高的 PK 暴露 (分子) 来确保达到最低 PK/PD 指数。也就是说,需要更高的抗菌药剂量治疗不敏感病原体。应该指出的是,使用 MICs 指导患者的抗菌药物剂量存在局限性,因为报告延迟和实验室检测结果差异导致 MICs 的滞后或者不准确。为了应对这些挑战,Mouton 等人建议,当 MIC 低于溶断点(breakpoint)时,应使用溶断点值作为 PK/PD 指数的分母。但是,当 MIC 超过溶断点时,建议使用比报告值高两个稀释度的值 (即,报告 MIC 4 mg/L,溶断点为 2 mg/L,则使用 16 mg/L)。
了解 PK/PD(药物暴露与病原体敏感性的相关性) 对抗菌药物个性化剂量至关重要,但鉴于重症患者病情危重,需要及时获得这些数据。为此,需要升级药敏检测方法,传统药敏检测方法可能需要 48-96 小时才能确定致病微生物的药物敏感性,微生物快速诊断法 (例如,多重 PCR 检测和快速全基因组测序) 也可以考虑应用。
通过床旁评估病人获得的抗菌药物暴露剂量并不一定能达到治疗效果的药物浓度 [2]。因此,应该考虑影响药物剂量的可能情况。首先,改变给药方式 (例如,延长β-内酰胺药物输注时间)。其次,根据患者肾功能或体重利用列线图(nomograms)计算剂量 [13]。第三,剂量软件,使用软件根据病人的特点确定剂量 [6]。第四,通过药物治疗浓度 (therapeutic drug monitoring , TDM) 监测药物暴露,然后根据需要调整剂量,以达到治疗剂量暴露 [14]。最后,将 TDM 与剂量软件相结合,应用贝叶斯预测进行更复杂的剂量调整 [15]。后三种剂量干预手段不经常使用,但是代表了最有可能确保个性化剂量的方法,有助于实现治疗剂量暴露。目前国内开展比较广泛的 TDM 监测主要药物是万古霉素,TDM 监测结果显示,常规剂量万古霉素治疗,不同研究结果显示约有 30%-50% 重症患者需要根据 TDM 调整剂量,达到最佳暴露。
无论医院或临床医生有多少资源 [1],都可以对每个重症患者进行 PK/PD 个性化抗菌药物剂量的管理。当然,更多的资源将增加剂量优化方法的复杂性。未来,可能会采用一种高度复杂的精确给药方法 (图 1)。这种方法将利用药物剂量软件给予有效经验抗菌药物,辅以快速诊断和药敏试验,以指导针对致病病原体的最佳抗菌药物选择。抗菌药物治疗的经验性用药剂量将再次使用药物剂量软件,随后的剂量优化使用 TDM 的迭代过程结合剂量软件中的贝叶斯预测 [4]。根据药物可能的毒性,较高的药物暴露剂量目标设定为最大限度的杀灭细菌或抑制耐药性。
综上所述,在重证患者中确保正确使用抗菌药物极具挑战性,但应将其视为进一步改善抗感染效果的关键措施。为此,需要一种更个性化的给药方法,即了解患者的药代动力学和病原体易感性 (MIC)。使用剂量干预,包括应用剂量软件和 TDM,有可能确保更多患者达到治疗目标药物暴露。到目前为止,这一领域还没有开展广泛和深入的研究,我们迫切的希望有研究来量化这种干预,并且进一步验证能在多大程度上改善临床治疗效果和患者生存率、减少耐药菌的出现。
图 1

孟玫 主任
山东省立医院重症医学科主任医师,医学博士。
中华医学会重症医学分会重症呼吸组学委员,山东省医学会重症医学分会副主任委员,主持省部级科研课题六项。
参考文献:
1. Tangden T, Ramos Martin V, Felton TW, Nielsen EI, Marchand S, Brugge-mann RJ, Bulitta JB, Bassetti M, Theuretzbacher U, Tsuji BT, WarehamDW, Friberg LE, De Waele JJ, Tam VH, Roberts JA, Infection Section forthe European Society of Intensive Care Medicine tP, PharmacodynamicsStudy Group of the European Society of Clinical M, Infectious DiseasestISoA-IP, the Critically Ill Patients Study Group of European Society ofClinical M, Infectious D (2017) The role of infection models and PK/PDmodelling for optimising care of critically ill patients with severe infec-tions. Intensive Care Med 43:1021–1032
2. Roberts JA, Paul SK, Akova M, Bassetti M, De Waele JJ, Dimopoulos G,Kaukonen KM, Koulenti D, Martin C, Montravers P, Rello J, Rhodes A, StarrT, Wallis SC, Lipman J, Study D (2014) DALI: defining antibiotic levels inintensive care unit patients: are current beta-lactam antibiotic doses suf-ficient for critically ill patients? Clin Infect Dis 58:1072–1083
3. Li C, Du X, Kuti JL, Nicolau DP (2007) Clinical pharmacodynamics of mero- penem in patients with lower respiratory tract infections. Antimicrob Agents Chemother 51:1725–1730
4. Roberts JA, Abdul-Aziz MH, Lipman J, Mouton JW, Vinks AA, Felton TW, Hope WW, Farkas A, Neely MN, Schentag JJ, Drusano G, Frey OR, Theuretz- bacher U, Kuti JL (2014) Individualised antibiotic dosing for patients
who are critically ill: challenges and potential solutions. Lancet Infect Dis 14:498–509
5. Dulhunty JM, Roberts JA, Davis JS, Webb SA, Bellomo R, Gomersall C, Shirwadkar C, Eastwood GM, Myburgh J, Paterson DL, Starr T, Paul SK, Lipman J (2015) A multicenter randomized trial of continuous versus intermittent beta-lactam infusion in severe sepsis. Am J Respir Crit Care Med 192:1298–1305
6. Heil EL, Nicolau DP, Farkas A, Roberts JA, Thom KA (2018) Pharmacody- namic target attainment for cefepime, meropenem, and piperacillin- tazobactam using a pharmacokinetic/pharmacodynamic-based dosing calculator in critically ill patients. Antimicrob Agents Chemother 62:e01008-18
7. Bergen PJ, Bulitta JB, Kirkpatrick CMJ, Rogers KE, McGregor MJ, Wallis SC, Paterson DL, Nation RL, Lipman J, Roberts JA, Landersdorfer CB (2017) Substantial impact of altered pharmacokinetics in critically ill patients on the antibacterial effects of meropenem evaluated via the dynamic hollow-fiber infection model. Antimicrob Agents Chemother 61
8. Beumier M, Casu GS, Hites M, Wolff F, Cotton F, Vincent JL, Jacobs F, Taccone FS (2015) Elevated beta-lactam concentrations associated with neurological deterioration in ICU septic patients. Minerva Anestesiol 81:497–506
9. Kalil AC, Metersky ML, Klompas M, Muscedere J, Sweeney DA, Palmer LB, Napolitano LM, O’Grady NP, Bartlett JG, Carratala J, El Solh AA, Ewig S,Fey PD, File TM Jr, Restrepo MI, Roberts JA, Waterer GW, Cruse P, Knight SL, Brozek JL (2016) Executive Summary: management of Adults With Hospital-acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis 63:575–582
10. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, Rochwerg B, Rubenfeld GD, Angus DC, Annane D, Beale RJ, Bellinghan GJ, Bernard GR, Chiche JD, Coopersmith C, De Backer DP, French CJ, Fujishima S, Gerlach H, Hidalgo JL, Hollenberg SM, Jones AE, Karnad DR, Kleinpell RM, Koh Y, Lisboa TC, Machado FR, Marini JJ, Marshall JC, Mazuski JE, McIntyre LA, McLean AS, Mehta S, Moreno RP, Myburgh J, Navalesi P, Nishida O, Osborn TM, Perner A, Plunkett CM, Ranieri M, Schorr CA, Seckel MA, Seymour CW, Shieh L, Shukri KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T, Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP (2017) Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med
11. Valenza G, Seifert H, Decker-Burgard S, Laeuffer J, Morrissey I, Mutters R (2012) Comparative activity of carbapenem testing (COMPACT) study in Germany. Int J Antimicrob Agents 39:255–258
12. Mouton JW, Muller AE, Canton R, Giske CG, Kahlmeter G, Turnidge J (2018) MIC-based dose adjustment: facts and fables. J Antimicrob Chem- other 73:564–568
13. Pea F, Viale P, Cojutti P, Furlanut M (2012) Dosing nomograms for attaining optimum concentrations of meropenem by continuous infusion in criti- cally ill patients with severe gram-negative infections: a pharmacokinet- ics/pharmacodynamics-based approach. Antimicrob Agents Chemother 56:6343–6348
14. Wong G, Briscoe S, McWhinney B, Ally M, Ungerer J, Lipman J, Roberts JA (2018) Therapeutic drug monitoring of b-lactam antibiotics in the criti- cally ill: direct measurement of unbound drug concentrations to achieve appropriate drug exposures. J Antimicrob Chemother in press
15. Neely MN, Kato L, Youn G, Kraler L, Bayard D, van Guilder M, Schumitzky A, Yamada W, Jones B, Minejima E (2018) Prospective trial on the use of trough concentration versus area under the curve to determine thera- peutic vancomycin dosing. Antimicrob Agents Chemother 62
更多重症感染内容,请点击查看 聚焦重症感染专题
