快臻作为一家主营快速诊断检测方案、细胞病毒学分析和分子诊断系统的厂家,秉承了快速与质量兼顾的信念,在 3 周内研发了新冠快速抗原检测试剂,并作为新冠快速筛查,获得了 FDA 首家审批。
近日,美国 NBC 电台报道了快臻获得 Sofia® 2 SARS 快速抗原检测的紧急授权,并对该产品的应用表示了期待和肯定。报道中强调:与现有的分子检测方法相比,抗原检测的成本更低,易于生产,检测速度也非常快,适合于大范围的新冠病毒检测。
有多家媒体对快臻获得 Sofia® 2 SARS 快速抗原检测紧急授权进行了报道,并在文中对抗原检测这一方法学的敏感性提出质疑。在此,快臻公司以 Sofia® 2 SARS 快速抗原检测和 Sofia 甲乙流快速抗原检测为例,对目前常见的一些疑问和质疑进行解答。
Q: 快臻的 Sofia® 2 SARS 快速抗原检测是检测病毒表面的分子吗?
A: 答案是否定的。首先,Sofia® 2 SARS Antigen FIA 采用的是三明治法荧光免疫技术,所检测的是该病毒的核衣壳蛋白。1 有相当一部分病毒抗原的检测项目,是针对病毒的表面分子。但对流感和新冠等呼吸道病毒,由于病毒的表面抗原容易发生变异,因此,应当检测病毒内部相对保守的核蛋白成分,这样做的优点是检测的特异性不会因为病毒表面的抗原变异而受到影响。Sofia® 2 SARS 快速抗原检测恰恰就是检测病毒内部的核蛋白成分,显然并非「病毒表面的分子」。
Q:普遍认为,抗原检测的敏感性有局限,即假阴性不可避免,快臻这款 Sofia® 2 SARS 快速抗原检测是否敏感性较低呢?
A:和病毒培养以及 RT-PCR 方法相比,抗原检测通常特异性的表现很好,而敏感性会有一定局限。通俗讲,检测得到的阳性结果基本都是真阳性,而当检测结果为阴性时,确实存在一定假阴性的概率,因此,对于阴性结果,建议再用核酸检测复核。
假阴性是指在比对实验中,作为金标准的检测方法报阳性的样本,比对的检测方法报出阴性结果。这种情况在任何定性检测中都可能存在,原因可能和产品本身性能有关外,也可能和样本的采集和处理有关(比如没有采集到病毒、样本被过度稀释或降解),还可能和患者发病后的检测时间有关(因为病毒侵入患者体内后进行繁殖达到试剂的检测限需要一定的时间)。
快速病原体检测是快臻的核心业务之一,因此公司一直致力于提升检测的性能,借助自身的研发优势和制造工艺,快臻在敏感性这一参数上一直表现优异。与 EUA 分子检测相比,同为 EUA 的 Sofia® 2 SARS 快速抗原检测其敏感性达到 80%,而临床特异性表现优异,达到 100%。2
Q:那么关于假阴性或假阳性,是否也同样存在于核酸检测呢?
A:其实任何一种检测方法都会存在假阳性和假阴性结果。尽管核酸检测的敏感性高于抗原检测,但假阳性和假阴性也不可避免。假阳性主要与环境污染有关,比如前序检测阳性样本对后续检测的影响。因此,核酸检测对环境要求严苛,操作流程必须规范。而假阴性主要与患者体内的病毒载量及样本的取材及处理有关。为减少假阴性的发生,需要多次多点采样检测,并在必要时重新采样复检。而抗原检测,由于没有级联放大效应,基本不会受到前序样本的影响,因此,基本不会有假阳性发生。
比如新冠疫情期间,同一疑似病人多次核酸检测均呈阴性后才被测出阳性这样的病例并不罕见。因此,也有专家建议可以配合使用抗原检测提高敏感性。
Q:快速抗原检测的优势在哪里?
A:任何一种检测都有其优劣势,关键是在合适的场景运用,操作过程尤其是采样环节需符合规范,当然检测产品的质量必须有保障。分子检测固然有着优异的敏感度和特异性,而且近年来分子诊断的检测速度也在大大提升,但不可否认分子诊断依旧存在着一些局限:比如,不是所有的医院门急诊都有条件配备 RT-PCR 或其他分子检测,而且普遍情况下分子检测耗时相对较长,且成本相对较高。因此,病原体的免疫学检查以其快速、便捷和低成本的优势更容易被普及。
另外,诊断的目的还是为有效治疗,就拿流感来说,通常建议的抗病毒治疗是在流感症状出现后的 48 小时内效果显著,而抗原检测的阳性率在这个时间窗内恰恰最高,对于用药最具指导意义。
诊断的准确度当然也和产品本身的性能和质量密切相关。 比如 Sofia Flu A+B FIA 流感检测(荧光免疫法),不仅可以在操作简单、15 分钟内快速出结果,且因为而且采用机器判读,结果客观准确,避免人为误差。而分子检测由于时效性相对较长,即使检测出了阳性结果,可能已错过最佳治疗时间,但对医学或流行病学研究还是很有意义的。所以,对于流感季节的大范围检测来说,流感的快速抗原检测可能更容易广泛开展,但,前提是产品的性能即敏感性特异性达到国家标准。
Q:Sofia Flu A+B FIA 在中国已经取得了 NMPA 注册证,那么这款产品的表现如何呢?
A:该款产品检测的是流感病毒较为保守的核蛋白成分,因此,基本不受病毒变异的影响。
以下是关于 Sofia Flu A+B FIA 使用不同样本的特性说明:
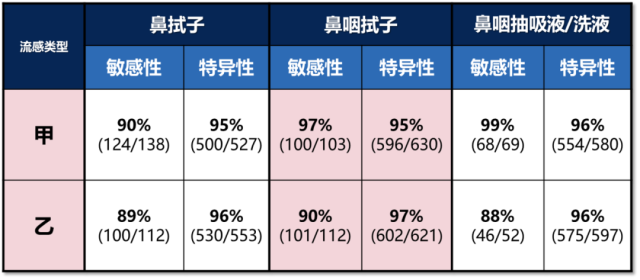
在不同的样本中,这款流感检测产品的敏感性以及特异性均大大超出了美国 FDA 对 RIDTs 的规定值。
值得一提的是 Sofia Flu A+B FIA 在美国不仅被归类为 CLIA 豁免 3 ,而且还属于 RIDTs 4,这意味着这类诊断除了适用于检验科,还可以在医院的临床科室、社区医疗等不同场所放心使用。更为重要的是这一测试的特异性和敏感性均达到了美国 FDA 的严格规定。这样的抗原检测项目在疫情爆发的情况下因其便捷易操作和可接受的检测准确性,非常适合普及,快速对疑似患者进行筛查。
此外,2019 年 10 月 11 日在 Frontiers in Microbiology 出版的《2018–2019 年流感季市售流感快速诊断试剂的敏感性》指出:
在考核的 23 种 IRDTs 中:
Sofia Influenza A + B FIA 是对季节性甲、乙型流感病毒最敏感的 IRDT。
Sofia Influenza A + B FIA 是 对 H5Nx 和 H7N9 病毒最敏感的 RIDT。
Sofia Influenza A + B FIA 对 H5 和 H7 病毒的检测有很高的敏感性,与对季节性甲、乙型流感病毒的敏感性相当,检测限为 101-104 TCID50 / 100 µL,提示该 IRDT 可诊断由此类病毒引起的流感。
参考来源:
1-2. Sofia® 2 SARS 快速抗原检测产品说明书
3.CLIA:美国国会临床实验室改进法案。如果产品获得 FDA 的 CLIA-豁免,则无需经过现场培训,即可在美国进行销售。Sofia 和 Sofia Influenza A + B FIA 有 CLIA-豁免,这意味着它们易于使用,即使操作人员未经过培训,出错的可能性也非常低;即使出错也不会造成严重的后果。
4.RIDT:Rapid Influenza Diagnostic Tests 流感快速检测,是符合美国食品药品管理局 (FDA) 标准的,专为检测流感病毒抗原而设计的免疫检测。通常在几分钟内完成测试,属于 CLIA 豁免产品。自 2018 年,美国 FDA 将流感快速检测从一类提升为二类,对于敏感性有了更为严格的要求,也会对 RIDTs 进行严格的年审制度。因此在美国,并不是所有检测流感的快速诊断都可以被称为 RIDTs。而快臻的几款流感测试,包括 Sofia FluA+B FIA 在内,都属于 RIDTs。
