夜深人静,电话铃响:患者孕 5 月,被马蜂蜇伤,需抗过敏治疗,我们医院哪种抗过敏药安全一点呀?来至临床的咨询电话。
马蜂蜇伤如何选择抗过敏药?▼
睡梦中我想起前段时间写过的 「甲氧氯普胺能否用于孕吐?」一文,刚好提到苯海拉明可用于孕期止吐,不由自主的对号入座了,既然孕吐可以用,抗过敏也是可以的吧,是不是这样呢?笔者带着疑问,进行验证,毕竟其治疗孕吐是二线用药。
一、FDA 对抗组胺药物的妊娠分级及安全性研究
提及妊娠安全用药,大家耳熟能详的就是美国食品药品监督管理局(FDA)关于妊娠期用药的 ABCDX 分类。2014 年 12 月,FDA 发布通告称因该分类系统过于简单,并不能有效传递妊娠期、哺乳期及潜在备孕男女的用药风险,而被弃用。
取而代之的是妊娠和哺乳期药品标签规则(Pregnancy and Lactation Labeling Rule,PLLR),新系统虽然能提供更为细致的孕期用药安全信息,但这项浩大的工程会持续数年之久,我们并不能快速获取相关信息。因此,ABCDX 分类依然在国内使用,并给我们提供参考。
考虑到这些问题,用药助手 App 内每个药品成分的哺乳妊娠安全性内容仍旧保留 FDA 的 ABCDX 分类,并且更新 FDA 新规定的 PLLR 规则;除此之外,在哺乳期安全用药方面新增更多人体研究数据(NIH 数据)、权威专科书籍的药代动力学参数表供大家临床参考。


1、FDA 对抗组胺药物的妊娠分级 [1]
大多数抗组胺药物都缺乏大规模的妊娠妇女对照研究或动物研究数据,笔者医院中被 FDA 分级为 B 类的抗组胺药物如下表所示:
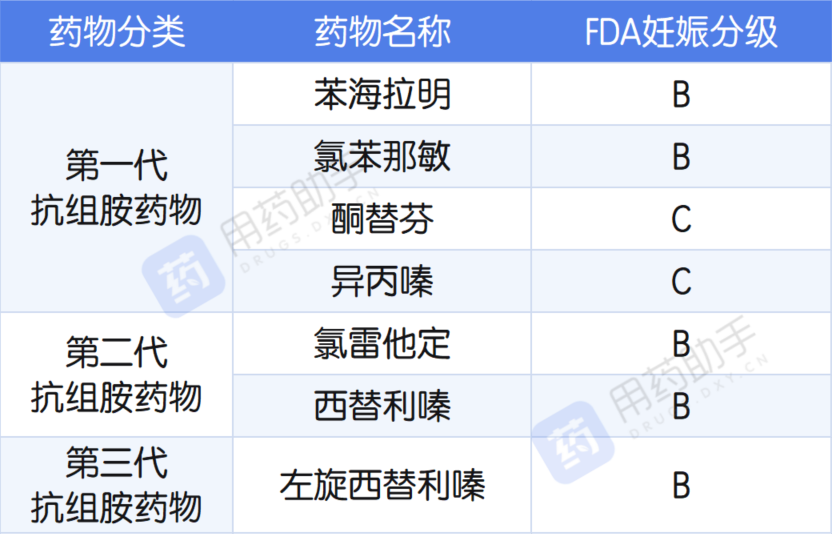
表 1 抗组胺药 FDA 妊娠分级
初步看来笔者医院供选择的分级为 B 级的药物还是比较多。

2、FDA 说明书——抗组胺药物的生殖安全性研究
(1)一代抗组胺药物
2017 年,FDA 颁布的以氯苯那敏为主要成分的药物说明书中指出 [1],在胚胎形成期全程给大鼠和兔子口服给药,氯苯那敏剂量达到人体每平米日最大推荐口服剂量的 20 和 25 倍,结果未显示不良后果。
但在小鼠试验中,妊娠期全程给药或在小鼠交配前对雌雄双方给药达到人体每平米日最大推荐口服剂量的 5 倍,小鼠胚胎出现损伤,后代出生后的存活率下降。
一项回顾性研究发现,孕妇使用氯苯那敏与胎儿发生腹股沟疝以及眼、耳异常轻度相关。另外一些回顾性研究认为,妊娠期使用氯苯那敏的妇女,其后代发生先天异常的几率并不会因为用药而升高。
2017 年,FDA 颁布的以异丙嗪为主要成分的药物说明书中指出 [3],给予妊娠期小鼠口服 2.1~4.2 倍人体日最大推荐口服剂量时,结果并未观察到致畸性。但当对小鼠进行 每天 25 mg/kg 异丙嗪腹腔 注射时,胚胎死亡率上升。
(2)二代抗组胺药物
2003 年,美国 FDA 的药物评价与研究中心 (Center for Drug Evaluation and Research, CDER) 对氯雷他定的批准文书中提到 [4],给大鼠和兔子口服氯雷他定,剂量达 96 mg/kg(接近于人体每平米日推荐最大口服剂量的 75~150 倍),结果并未显示生殖毒性。
2007 年,CDER 发布以西替利嗪为主要成分的产品的医学综述 [5],其中提到,在小鼠、大鼠和兔子实验中,口服给药西替利嗪,剂量分别为 96、135 和 225 mg/kg(接近于人体每平米日推荐最大口服剂量的 40、180 和 220 倍),结果并未观察到致畸性。
二、抗组胺药物的人体安全性研究文献
1、一代抗组胺药物
一代抗组胺药由于其长久的使用历史,有大量的妊娠期使用数据可供参考并被充分研究 [6]。大多数经典文献都显示一代抗组胺药与出生缺陷的风险升高无直接关系 [7]。
● Heinonen 等 [8] 在一项调查多种药物致畸性的大规模前瞻性研究中发现,氯苯那敏与视力及听力缺陷有相关性。
● 一项根据德国数据进行分析的队列研究显示,妊娠初期使用美克洛嗪、氯苯那敏、茶苯海明组 (11/628) 与未用药的对照组 (12/628) 相比,在导致出生缺陷的几率上没有明显差别 [9]。
● 有研究报道了一代抗组胺药与 1976-1990 年 Slone 流行病研究中心的出生缺陷数据之间的关系,76 例胎儿腹裂案例中有 10 例 (13.2%) 的母亲在妊娠期使用过抗组胺药 [10]。
● 然而在更新的 Slone 流行病研究中心的出生缺陷研究数据分析中 (1995-1999),206 例腹裂案例中,抗组胺药与腹裂之间不存在相关性。根据 126 例小肠闭锁案例进行的分析认为,抗组胺药与其也不存在关联 [11]。
● 妊娠前 3 个月应用苯海拉明被证明与胎儿腭裂的发生有关 [12]。但美国国家出生缺陷预防研究 (NBDPS) 中的一个多研究中心的全人群病例对照研究发现,苯海拉明和唇裂、腭裂、神经管缺陷或下尿道下裂之间没有关联 [13]。
2、二代抗组胺药物
大量关于氯雷他定和西替利嗪的研究显示,两者在妊娠期使用与出生缺陷风险的升高并没有关系。且 Namazy 等 [14] 认为,当妊娠期需要使用抗组胺药时,二代抗组胺药氯雷他定和西替利嗪被认为是最好的选择。
● Moretti 等 [15] 从加拿大、巴西、意大利和以色列的四个致畸信息服务参与基地收集了产妇用药史和药物暴露情况,并对妊娠并发症和生产结果进行随访。
● 结果发现,妊娠期使用氯雷他定的 143 例孕妇组中有 5 例新生儿畸形 (3.5%),150 例未使用药物的对照组中有 6 例 (4.0%),两组结果并无显著差异。一项队列研究观察了 63 名妊娠初期使用氯雷他定的妇女,并未发现氯雷他定导致主要致畸性升高 [16]]。
● Diav-Citrin 等 [17] 观察了 210 例妊娠期使用氯雷他定 (77.9% 在妊娠初期使用) 和 267 例妊娠期使用 (64.6% 在妊娠初期使用) 其他抗组胺药病例的妊娠结果,并与未使用药物的对照组的 929 例样本进行比较。结果显示,氯雷他定组、其他抗组胺药物组、未使用药物对照组的先天异常比例并无显著差异。
● Källén 和 Olausson[18] 收集了瑞典医学出生登记中心 1995-2001 年间 2780 名在妊娠期使用了氯雷他定的孕妇所生胎儿中,有 15 名尿道下裂 (5.4‰),远高于普遍患病率 2‰。
● 此后的研究认为是没有控制家族史和产龄等混杂因素导致。为此再次分析了 2002~2004 年 1911 例婴儿,患有尿道下裂的几率为 1.04‰,远低于 1995-2001 年的结果。完整分析 1995-2004 年的数据,结果明显比五年前得到的要小 [19]。
● Schwarz D 等 [20] 对 1999 年 1 月至 2007 年 8 月的相关文献进行了系统评价和 meta 分析 ‚包括来自巴西、加拿大、丹麦、以色列、意大利、瑞典、英国和美国的 453053 例男婴 ‚在 2694 例暴露于氯雷他定的男婴中有 39 例出现尿道下裂(1.4%)‚450413 没有暴露于氯雷他定的男婴中有 4231 例(0.9%)出现尿道下裂 ‚研究结论为妊娠使用氯雷他定不会明药显升高尿道下裂的风险。
● 西替利嗪在已应用的 1300 例妊娠中,未发现其致畸风险 [21-24]。

三、妊娠期使用抗组胺药物的推荐
由于缺乏足够高质量的妊娠期人体研究数据,几乎所有 药物说明书中都建议,只有在有明确指征时,根据用药带来的收益和风险,谨慎考虑使用。
● Mazzotta P 等 [25] 在对妊娠期药物治疗的系统评价中指出第一代和第二代抗组胺药物均未发现有致畸作用,但是由于第一代抗组胺药被使用时间更长,有更多的使用安全的证据,所以使用率更高。两者总体而言是比较安全的。
● Vlastarakos 等 [26] 在研究大量文献后认为,妊娠后期使用西替利嗪或妊娠中、后期使用氯雷他定是相对比较安全的。
目前更多学者认为,第一代抗组胺药由于其较弱的受体选择特异性、镇静及抗胆碱作用,理论上孕妇使用会有对胎儿不利的较高风险,因此一般不建议使用,应首选第二代抗组胺药。
因此,《抗组胺药在皮肤科应用专家共识(2017 版)》及《中国荨麻疹诊疗指南 (2018 版)》指出:目前没有属于 A 类的抗组胺药。妊娠期在权衡风险后应首选氯雷他定及西替利嗪。
《Drugs During Pregnancy and Lactation》[27] 第八版结合临床研究数据,给出了妊娠期使用抗组胺药的用药建议:氯雷他定和西替利嗪是研究最充分的抗组胺药,应为该类药的首选。
四、小结
由此可见,苯海拉明在抗过敏治疗中同孕期止吐一样,多为二线选择,同时应避免在妊娠后三个月使用,因为其催产素样作用可能会导致子宫收缩 [28]。

策划:圆脸大侠
编辑:瓜叽呀
投稿:drugs@dxy.cn
参考文献:
[1] 霍记平, 孙楚枫, 杨树, 梅升辉, 赵志刚. 妊娠期使用抗组胺药物的安全性探讨 [J]. 药品评价,2018,15(02):11-15.
[2] FDA. CII ZUTRIPRO® Oral Solution[OL]. https: //www. accessdata. fda. gov/drugsatfda_docs/label/2017/022439s009lbl. pdf, 2017-8-30.
[3] Kalpaklioglu F, Baccioglu A. Efficacy and safety of H1-antihistamines: an update[J]. AntiinflammAntiallergy Agents Med Chem, 2012, 11(3): 230-237.
[4] FDA. Loratadine Orally Disintegrating Tablets(OTC)[OL]. Center for Drug Evaluation and Research, 2003-02-10.
[5] FDA. Final printed labeling ANDA 78-336[OL]. Center for Drug Evaluation and Research,2007-12-17.
[6] Sumit Kar, Ajay Krishnan, Preetha K, et al. A review of antihistamines used during pregnancy[J]. J Pharmacology and Pharmacotherapeutics, 2012, 3(2): 105-108.
[7] SM Gilboa, EC Ailes, RP Rai, et al. Antihistamines and Birth Defects: A Systematic Review of the Literature[J]. Expert Opin Drug Saf, 2014, 13(12): 1667-1980.
[8] Dávila I, Cuvillo A, Mullol J, et al. Use of Second Generation H1 Antihistamines in Special Situations[J]. J InvestigAllergolClinImmunol, 2013, 23(1): 1-16.
[9] Michaelis J, Michaelis H, Gluck E, et al. Prospective study of suspected associations between certain drugs administered during early pregnancy and congenital malformations[J]. Teratology, 1983, 27: 57-64.
[10] Werler MM, Mitchell AA, Shapiro S. First trimester maternal medication use in relation to gastroschisis[J]. Teratology, 1992, 45: 361-367.
[11] Werler MM, Sheehan JE, Mitchell AA. Maternal medication use and risks of gastroschisis and small intestinal atresia[J]. Am J Epidemiol, 2002, 155: 26-31.
[12] Gilbert C,Mazzotta P,Loebstein R,et al. Fetal safety of drugs used in the treatment of allergic rhinitis: a critical review[J].Drug Saf,2005,28( 8) : 707-719.
[13] Anderka M, Mitchell AA, Louik C et al. Medications used to treat nausea and vomiting of pregnancy and the risk of selected birthdefects. Birth Defects Res A Clin Mol Teratol 2012; 94: 22-30.
[14] Namazy JA, Schatz M. The Treatment of Allergic Respiratory Disease During Pregnancy[J]. J InvestigAllergolClinImmunol, 2016, 26(1): 1-7.
[15] Kalpaklioglu F, Baccioglu A. Efficacy and safety of H1-antihistamines: an update[J]. AntiinflammAntiallergy Agents Med Chem, 2012, 11(3): 230-237.
[16] Diav-Citrin O, Shechtman S, Moerman L, et al. Pregnancy outcome following gestational exposure to loratadine and other antihistamines: a prospective controlled cohort study[J]. Teratology, 2001, 63: 260.
[17] Diav-Citrin O, Shechtman S, Aharonovich A, et al. Pregnancy outcome after gestational exposure to loratadine or antihistamines: A prospective controlled cohort study[J]. J Allergy ClinImmunol, 2003, 111: 1239-1243.
[18] Källén B, Olausson PO. Monitoring of maternal drug use and infant congenital malformations. Does loratadine cause hypospadias?[J]. Int J Risk Safety Med, 2001, 14: 115-119.
[19] Källén B, Olausson PO. No increased risk of infant hypospadias after maternal use of loratadine in early pregnancy[J]. Int J Med Sci, 2006, 3: 106-107.
[20] Schwarz D , Moretti M E , Nayak S , et al. Risk of hypospadias in offspring of women using loratadine during pregnancy: a systematic review and meta-analysis.[J]. Drug Safety, 2008, 31(9):775-788.
[21] Källén B. Use of antihistamine drugs in early pregnancy and delivery outcome. J Matern Fetal Neonat Med 2002; 11: 146-152.
[22] Anderka M, Mitchell AA, Louik C. Medications used to treat nausea and vomiting of pregnancy and the risk of selected birth defects.Birth Defects Res(Part A) 2012; 94: 22-30.
[23] Djokanovic M, Moretti M, Boskovic, R. Fetal safety of cetirizine use in pregnancy - a prospective controlled cohort study {Abstract}.Birth Defects Research(Part A) 2010; 88: 438.
[24] Weber-Schdorfer C, Schaefer C. The safety of cetirizine during pregnancy. A prospective observational cohort study. Reprod Toxicol2008; 26: 19-23.
[25] Mazzotta P , Loebstein R , Koren G . Treating allergic rhinitis in pregnancy. Safety considerations.[J]. Drug Safety, 1999, 20(4):361-375.
[26] Vlastarakos PV,Manolopoulos L,Ferekidis E, et al. Treating common problems of the nose and throat in pregnancy :What is safe[J].Eur Arch Otorhinolaryngol,2008,265(2) :499-508.
[27] (德)C. 舍费尔 (Christof Schaefer) 等著. 孕期与哺乳期用药: 原书第八版 [M]. 吴效科, 黄志超主译. 一北京: 科学出版社,2021,1:44-45.
[28] Brost BC, Scardo JA, Newman RB. Diphenhydramine overdose during pregnancy: lessons from the past. Am J Obstet Gynecol 1996;175: 1376-7.
